Deux séquences pédagogiques utilisant l’électrophorèse sont ici proposées :
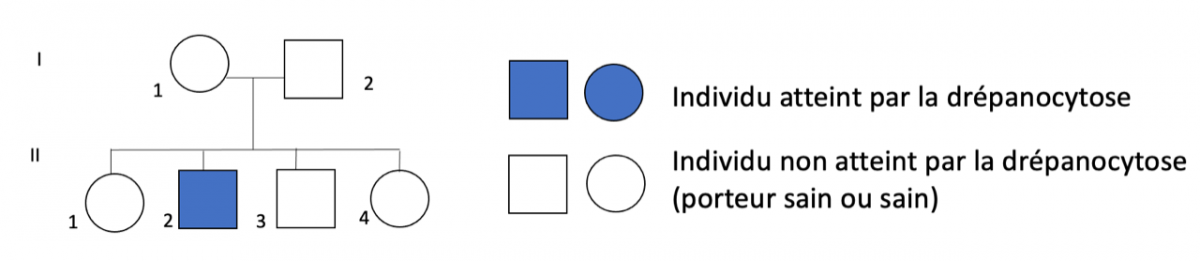
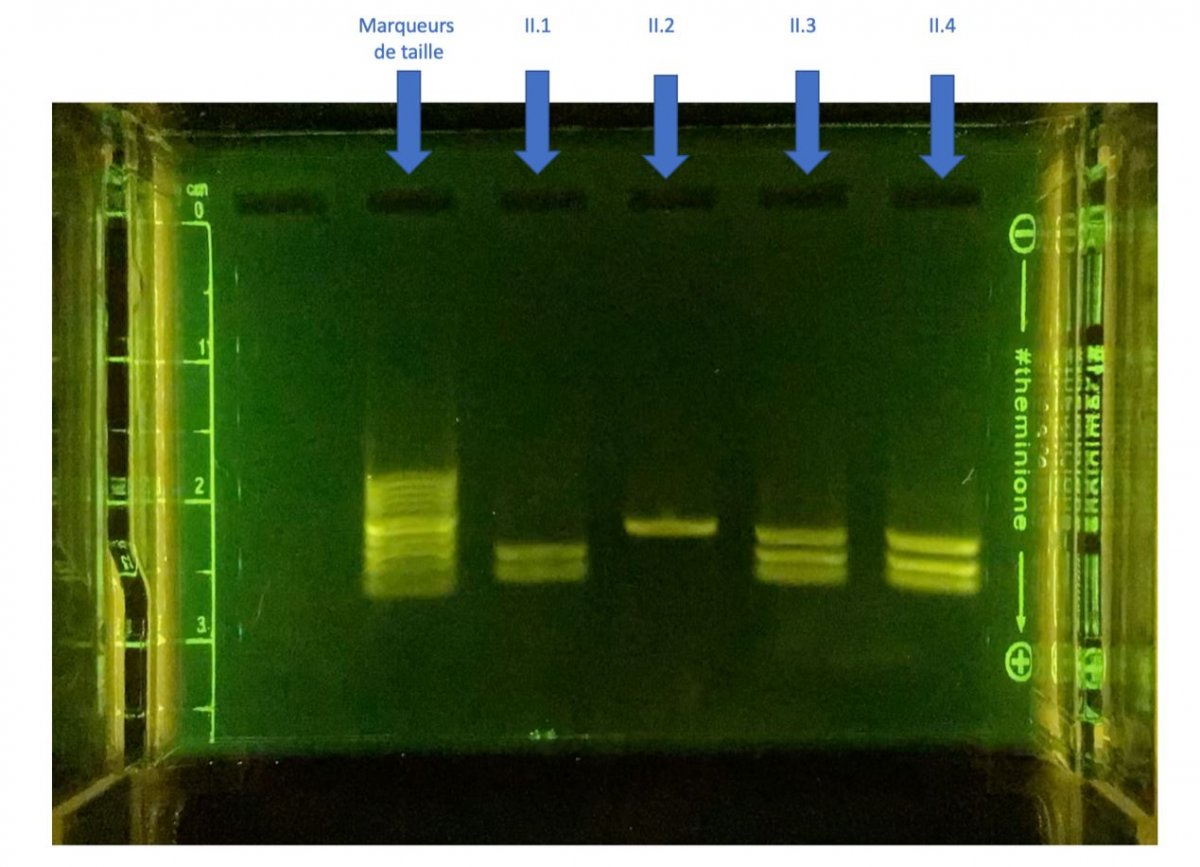
- la première séquence propose de déterminer le génotype des individus d’une famille touchée par la drépanocytose afin de déterminer un donneur de moelle osseuse potentiel en lien avec le programme de spécialité en Première.
- la deuxième séquence propose de déterminer la présence d’un gène de résistance à l’oïdium chez la vigne en lien avec le programme de spécialité en Terminale.

| MOTIVATION |
|---|
| Découvrir et mettre en œuvre une technique de laboratoire : l’électrophorèse, et mieux comprendre les documents présentant les résultats obtenus avec cette technique. Comment mettre en œuvre une électrophorèse en classe et mieux comprendre son principe ? |
Focus sur une technique : l’électrophorèse
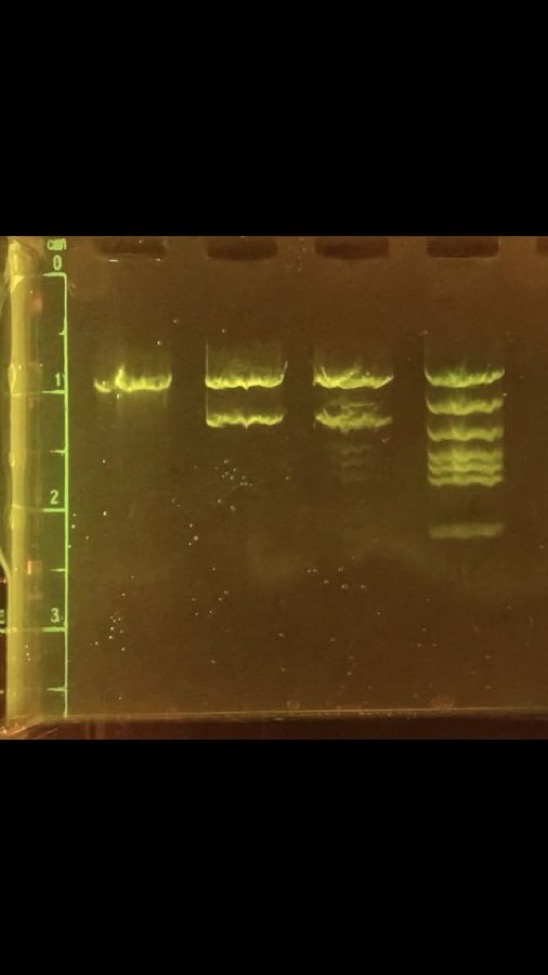
L’ensemble de la préparation, de la réalisation et de l’observation de l’électrophorèse est réalisable en moins d’1h. L’obtention très rapide de résultats permet la réalisation d’électrophorèses au cours d’une même séance de TP. La possibilité d’observer en direct la migration et de réaliser un time-lapse permet une bonne compréhension du principe de la manipulation.
Afin de préparer cette séance s’appuyant sur plusieurs gestes techniques qui peuvent être difficiles à maîtriser par les élèves, il est possible de s’initier à l’utilisation de la micropipette pour réaliser les dépôts des échantillons d’ADN dans les puits avec l’interface en ligne LabXchange.
NB : Voir l’article de Sébastien Bergeot : L’utilisation de simulateurs virtuels de laboratoire pour s’entrainer aux gestes techniques.
| PRINCIPE DE ÉLECTROPHORÈSE |
|---|
| En milieu basique, les molécules d’ADN sont chargées négativement. Soumises à un champ électrique, elles migrent, dans un gel conducteur, de la cathode (borne négative) vers l’anode (borne positive).
|
Résultat de migration du marqueur de taille M par électrophorèse 
marqueur M
|
Vidéo du protocole d’électrophorèse
| Fiche technique générale pour une électrophorèse réalisée avec une cuve de type MiniOne réalisée par Roseline Delcourt et Myriam Benbihi |
|---|
| Coût |
|---|
|
Avantages / Plus-values
- Permettre aux élèves de s’approprier une méthode de biologie moléculaire de laboratoire, que l’on retrouve fréquemment dans les exercices.
- Utiliser la micropipette.
- Utiliser un dispositif d’électrophorèse du coulage du gel aux résultats.
1ère séquence (Première Spécialité SVT) : Détermination du génotype
Professeur expérimentateur
Nathalie ROUSSEAU, au lycée Jeanne d’Albret à Saint-Germain-en-Laye (78)
| LIAISON AVEC LE PROGRAMME | |
|---|---|
| Niveau concerné | Première Spécialité SVT |
| Partie du programme | CORPS HUMAIN et SANTÉ, Variation génétique et santé |
| PLACE DANS LA PROGRESSION |
|---|
| L’examen des arbres généalogiques familiaux permet de connaître les modes de transmission héréditaire des déterminants génétiques responsables. L’étude de génomes de grandes cohortes de patients est à la base de l’identification de gènes correspondants. Dans le cas d’une maladie monogénique à transmission autosomique récessive, seuls les homozygotes pour l’allèle muté sont atteints. Les hétérozygotes sont porteurs sains. Selon les cas, les traitements apportés visent à compenser par des médicaments la fonction altérée ou à contrôler les conditions de milieu. Dans certains cas, on peut envisager une thérapie génique visant à remplacer l’allèle muté dans les cellules du tissu atteint. Cette partie a été traitée plusieurs mois après avoir traité la première partie du programme : "Transmission, variation et expression du patrimoine génétique". Cela permet une réactivation des notions déjà vues en génétique, en l’appliquant ici à la recherche de génotypes dans une famille ici atteinte par la drépanocytose. |
| Outils numériques et ressources | ||
|---|---|---|
| Genigen2 en ligne |
Séquences de la famille |
Genially |
Déroulement global de la séquence
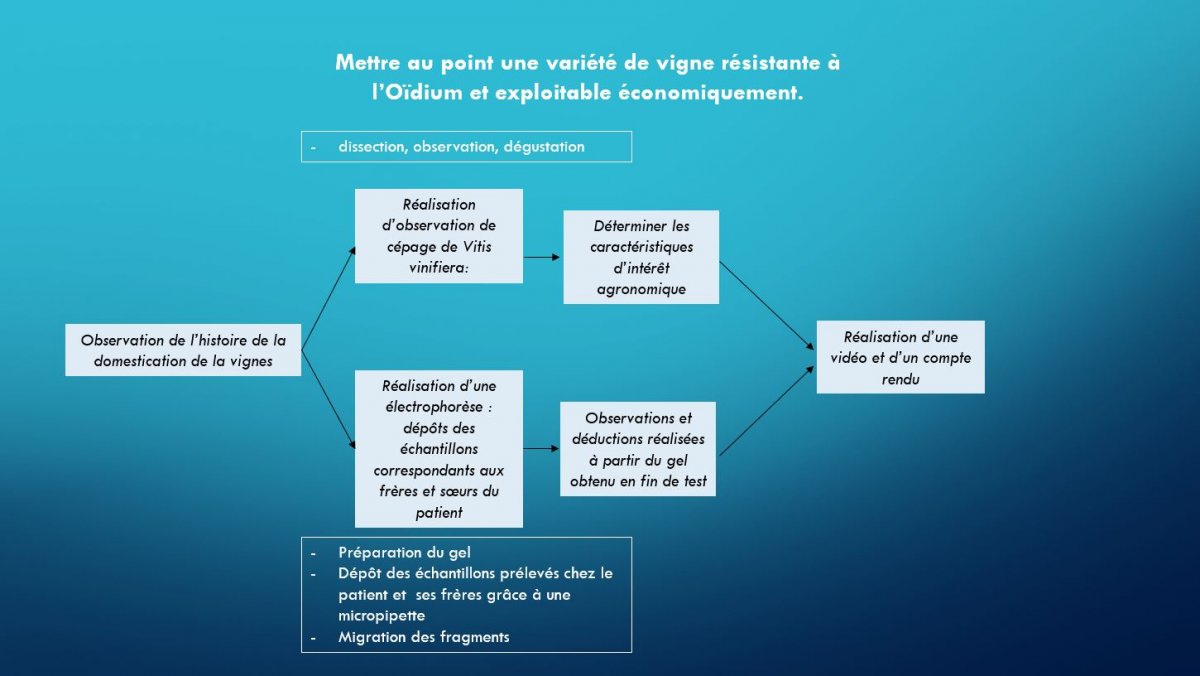
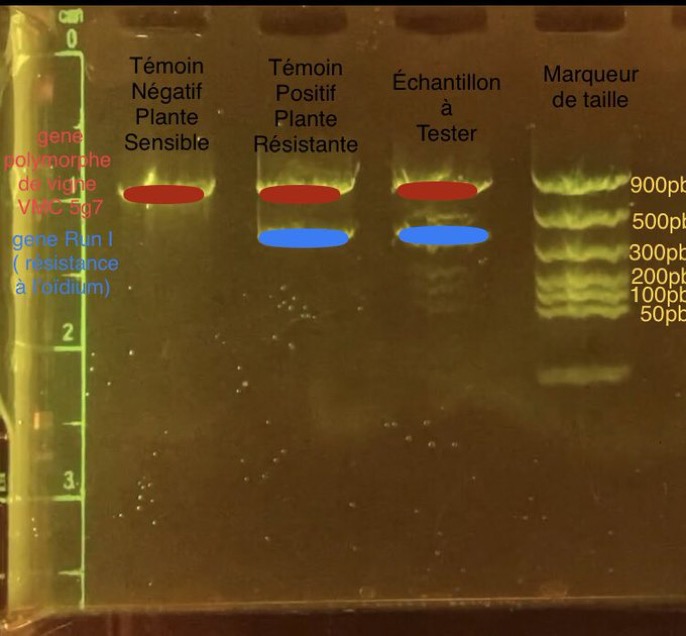
2ème séquence (Terminale Spécialité SVT) : Détermination du génotype d’un pied de vigne, recherche de la présence du gène de résistance à l’oïdium
Professeur expérimentateur
Amaury TAVERNIER, au lycée Jeanne d’Albret à Saint-Germain-en-laye (78)
| LIAISON AVEC LE PROGRAMME | |
|---|---|
| Niveau concerné | Terminale Spécialité SVT |
| Partie du programme | La domestication des plantes |
| PROBLÈME À RÉSOUDRE |
|---|
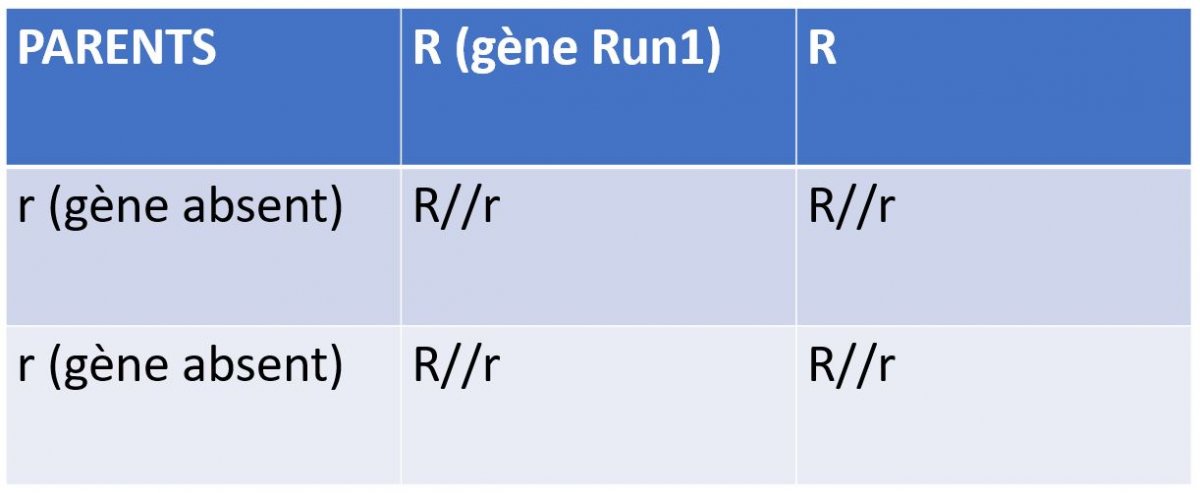
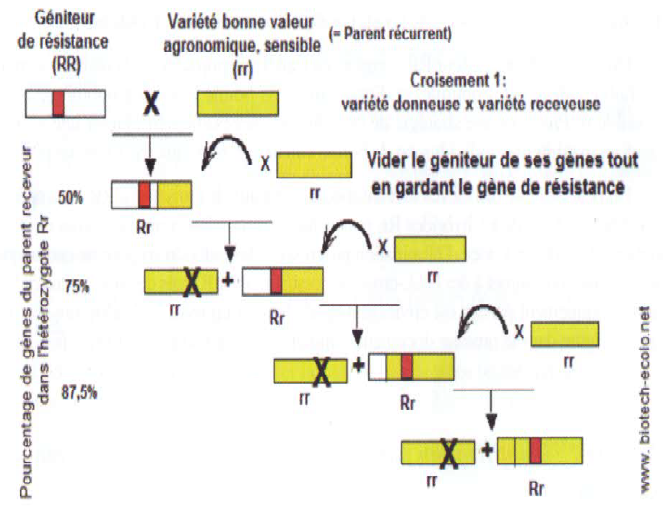
| Comment mettre au point une variété résistante de vigne, qui contient un gène de résistance à l’Oïdium Run1 et qui peut être exploitable économiquement ? |
Déroulement global de la séquence
Retours, analyse et pistes d’amélioration
| RETOUR DES IMPRESSIONS DES ÉLÈVES |
|---|
|
| ANALYSE ET ÉVALUATION DU DISPOSITIF | |
|---|---|
| Plus-values dégagées | Les élèves maîtrisent l’ensemble de l’expérience depuis le coulage du gel jusqu’à la migration. Ils apprécient pouvoir observer en temps réel la migration du gel où il est possible d’observer la séparation des fragments d’ADN. Séquence Première :
|
| Difficultés rencontrées | Pour les deux séquences :
|
| Pistes d’amélioration | Préparer le TP en amont et à distance, notamment pour préparer l’apprentissage du geste avec une micropipette virtuelle (voir l’article de S. Bergeot) |