Liaison avec le programme
On se situe dans le thème 1-A-1 du programme de Terminale S : Le brassage génétique et sa contribution à la diversité génétique.
Les élèves auront préalablement vu les brassages inter et intrachromosomique au cours de la méiose.
Extrait programme (BO)
| Connaissances | Capacités, attitudes |
|---|---|
| Au cours de la fécondation, un gamète mâle et un gamète femelle s’unissent : leur fusion conduit à un zygote. La diversité génétique potentielle des zygotes est immense. Chaque zygote contient une combinaison unique et nouvelle d’allèles. Seule une fraction de ces zygotes est viable et se développe. |
Observer et interpréter des observations microscopiques relatives à la fécondation. Réaliser une analyse statistique simple des résultats d’une fécondation. Décrire schématiquement un exemple de fécondation et ses conséquences génétiques. |
Situation déclenchante et problématique
Selon François Jacob (prix Nobel de médecine, 1965), la sexualité peut être considérée comme une « machine à faire du différent ». Dans cette citation, on ne perçoit pas les parts respectives de la méiose et de la fécondation dans la diversification génétique.
– Quel est le devenir, lors de la fécondation, de la diversité des gamètes issus des brassages survenus lors de la méiose ?
Activité
Matériel et ressources
| Document-ressource | Chez la drosophile, le gène SE (pour sepia), porté par la paire de chromosomes n°3, régit la couleur de l’œil. L’allèle sauvage de ce gène détermine la couleur rouge brique, un allèle muté de ce gène détermine la couleur sepia (marron foncé). Un autre gène, noté AP (pour apterous), porté par la paire de chromosomes n°2, intervient dans le développement de l’aile. L’allèle sauvage de ce gène assure le développement d’ailes de longueur normale, un allèle muté de ce gène conduit à l’absence d’ailes. Deux croisements ont été réalisés :
– Premier croisement : on croise deux drosophiles de race pure : une drosophile à ailes longues et à œil rouge brique (P1) avec une drosophile sans ailes et à œil sépia (P2). On obtient en première génération (F1) composée de 100% de drosophiles à ailes longues et à œil rouge brique. – Deuxième croisement : on croise des drosophiles femelles de la génération F1 avec des drosophiles mâles de la génération F1. On obtient une génération F2. |
| Document référent | |
| Matériel | Flacons contenant des drosophiles vivantes nées du deuxième croisement - Matériel pour l’anesthésie des drosophiles - Loupe binoculaire et/ou loupe à main pour l’observation des drosophiles |
| Documentation technique |
Enoncé du travail
Un déroulement possible ...
1. Réflexion autour d’une stratégie de résolution
D’après le document-ressource, on sait que les gènes AP et SE sont indépendants. Le descriptif du premier croisement permet d’établir que le génotype des F1 est (ap+/ap, se+/se).
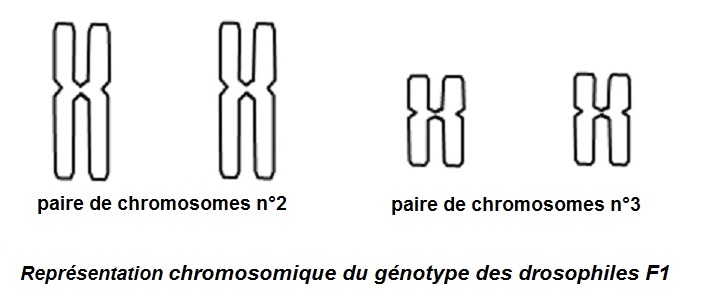

Les connaissances sur le brassage interchromosomique pour deux gènes indépendants conduisent aux génotypes et fréquences des différents gamètes produits par chaque parent hétérozygote F1 impliqué dans le deuxième croisement. On peut donc initier la construction d’un échiquier de croisement F1 x F1 :
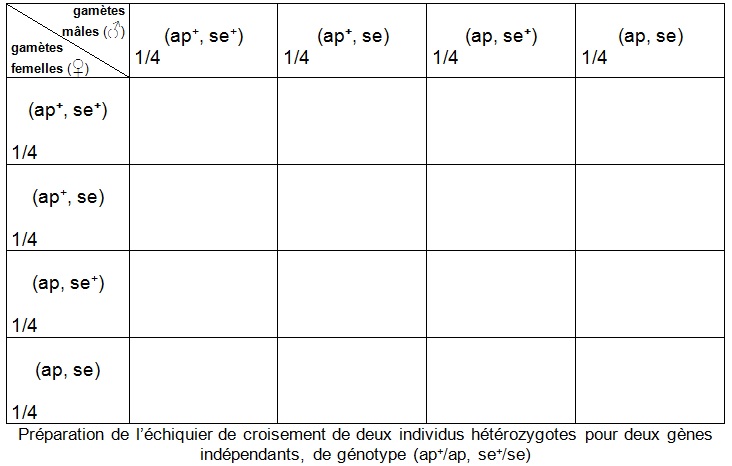
Par "rencontre au hasard " des gamètes, on entend que chaque type de gamète mâle est susceptible de s’unir à chacun des différents types de gamètes femelles. En posant cette hypothèse d’une rencontre aléatoire de gamètes, la probabilité d’obtention de tel ou tel zygote s’obtient en multipliant la fréquence des gamètes correspondants.
Si les gamètes se rencontrent aléatoirement, il y a équiprobabilité des rencontres et les proportions dans l’échiquier deviennent :
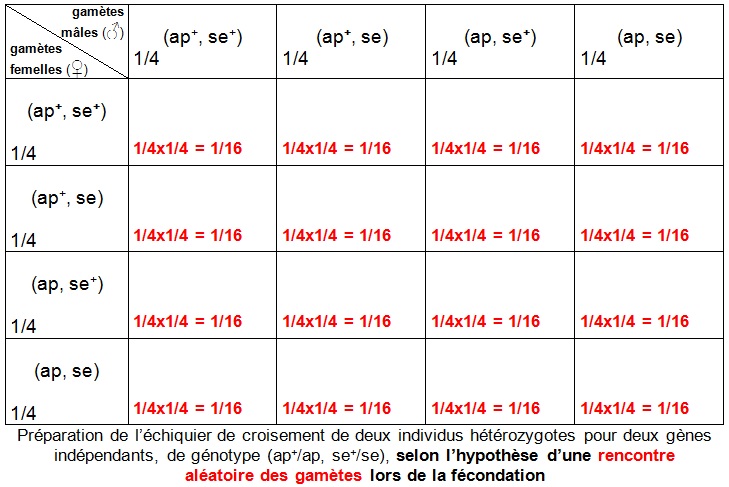
La stratégie de résolution va donc consister à :
– d’une part, remplir l’échiquier de croisement théorique obéissant à l’hypothèse d’une rencontre au hasard des gamètes et déduire de cet échiquier les phénotypes attendus en F2 et leurs proportions ;
– d’autre part, observer et décompter les phénotypes des mouches de la génération F2 ;
– pour finir, confronter le réel (contenu du flacon F2) et les résultats hypothétiques (échiquier prévisionnel) afin de valider l’hypothèse d’une rencontre au hasard des gamètes lors de la fécondation.
– bien entendu, l’apparition de nouveaux phénotypes en F2 permettra de montrer que la fécondation crée de la diversité génétique. Si les prédictions de l’échiquier sont corroborées par le réel, on pourra s’appuyer sur l’échiquier pour mettre en valeur les nouveaux génotypes.
2. Mise en œuvre du protocole
– Le KIT 5 de drosophiles vivantes "2 gènes sur 2 chromosomes différents : apterous [ap] et sepia [se]" (réference 101/K5) commercialisé par Sordalab permet de réaliser ce TP. Il contient 2 tubes F1, 5 tubes F2 et 3 tubes BC (croisement-test). Des tubes supplémentaires F2 peuvent être achetés. Pour un groupe de TP (9 binômes), prévoir deux tubes et deux postes d’anesthésie. Des mouches endormies puis réveillées sous la conduite d’un groupe peuvent être réutilisées par le groupe suivant, ou bien par une autre classe.
– Le liquide anesthésiant utilisé pour l’endormissement des mouches peut être du Flynap (fournisseur : Sordalab), avec des conditions de sécurité à respecter (Facilement inflammable. Nocif par inhalation, contact avec la peau et par ingestion. Provoque de graves brûlures). À défaut, les mouches peuvent être endormies à l’éther (produit qui -en pharmacie- n’est délivré que sur ordonnance) avec les mêmes précautions d’emploi.
– Trucs et astuces :
— > Afin de limiter les vapeurs de liquide anesthésiant, l’endormissement doit se faire sous une hotte aspirante ou près d’une fenêtre grande ouverte. Des dispositifs de type étheriseurs (fournisseur : Sordalab) permettent de limiter les vapeurs.
— > Il arrive que des mouches montrent les premiers signes du réveil alors que le comptage n’est pas terminé ! Dans ce cas, il faut les piéger sous le couvercle d’une boîte de pétri en compagnie d’un minuscule morceau de coton imprégné d’un peu de liquide anesthésiant.
– Afin de mener une étude statistique, les comptages réalisés par les différents binômes sont mutualisés.
– Voici des exemples de comptages effectués par des groupes d’élèves :

Il peut être très intéressant d’utiliser un google document en ligne pour mutualiser les résultats du comptage (avantage immédiat : affichage en direct au tableau avec un vidéoprojecteur). En voici un exemple : tableau collaboratif
3. Présentation des résultats et exploitation de ces derniers pour répondre au problème
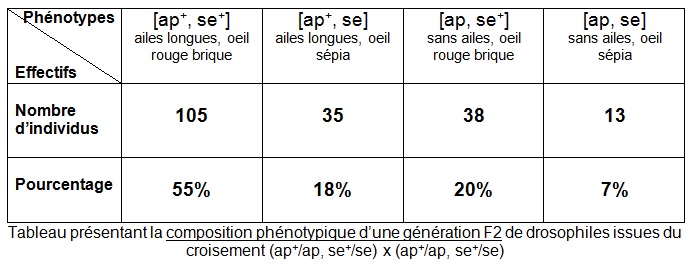
– Présentation des résultats du comptage
– Présentation de l’échiquier prévisionnel et comparaison avec le réel
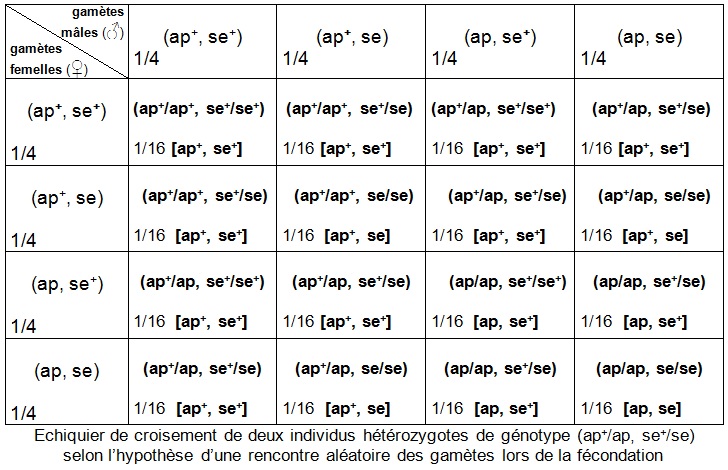
On obtient par cette construction théorique 9/16 soit 56% de drosophiles [ap+, se+] ; 3/16 soit 19% de drosophiles [ap, se+] ; 3/16 soit 19% de drosophiles [ap+, se] ; 1/16 soit 6% de drosophiles [ap, se].
On voit que les résultats théoriques (prédictions de l’échiquier de croisement simulant une rencontre aléatoire des gamètes) sont très semblables aux résultats effectifs (inventaire statistique de la génération F2).
On peut valider l’hypothèse d’une réunion au hasard des gamètes lors de la fécondation..
– Mise en valeur de la diversité génétique créée par la fécondation
Dans la descendance F2, on relève des phénotypes nouveaux : [ap+, se], [ap, se+] et [ap, se], révélateurs d’une diversification génétique.
Dans l’échiquier de croisement qui vient d’être validé, on peut mettre en relief les génotypes nouveaux. Il s’agit de tout génotype différent du génotype parental (ap+/ap, se+/se).
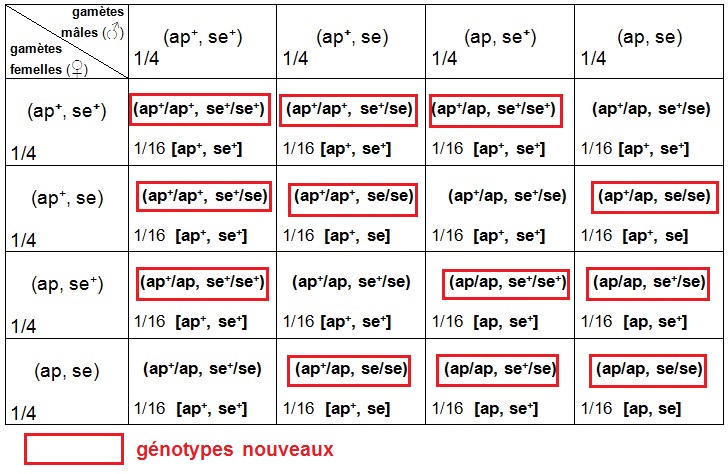
Nous mettons en évidence pléthore de génotypes nouveaux. Notre étude illustre donc bien la citation de François Jacob : "la sexualité peut être considérée comme une machine à faire du différent".
Pour mettre en valeur les conséquences génétiques de la fécondation, on peut remarquer que le nombre de génotypes possibles pour le zygote (neuf génotypes différents dont huit génotypes nouveaux) est supérieur au nombre de génotypes possibles pour les gamètes (quatre génotypes différents). On dit que la fécondation amplifie le brassage génétique occasionné par la méiose.
Auteur de cet article : Anne FLORIMOND, lycée Richelieu, Rueil-Malmaison
Remerciements à Laurent Guerre pour sa relecture, son aide et ses conseils.


