– Des exemples d’utilisations pédagogiques possibles
– Téléchargement du logiciel :
Présentation du logiciel
Ce logiciel est une banque d’images de préparations microscopiques réalisées sur des embryons mâles et femelles de bovin. Utilisable dans le cadre de la classe, il permet à l’élève de retracer à partir d’un calendrier les grandes étapes de la différenciation des gonades et des conduits génitaux.
La navigation se fait à partir d’un calendrier et permet d’explorer au choix le développement mâle ou femelle.
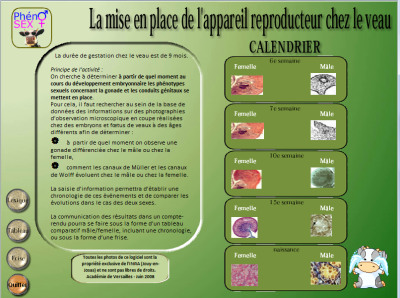
Sur la page est visible une image de préparation microscopique du stade correspondant, dont certains détails pourront être agrandis en cliquant sur la loupe.
En bas de chaque pas se retrouve le calendrier qui permet de passer facilement d’une page à une autre, où que l’on soit dans le logiciel.
La saisie d’information permettra d’établir une chronologie de ces événements et de comparer les évolutions dans le cas des deux sexes.
La communication des résultats dans un compte-rendu pourra se faire sous la forme d’un tableau comparatif mâle/femelle, incluant une chronologie, ou sous la forme d’une frise inclus dans le logiciel.
Ce logiciel doit être téléchargé et installé sur l’ordinateur : après décompression, cliquer sur install :
En cas de problème de droits sur le réseau, une version au format html, (sans la frise ni le tableau pour des raisons techniques) :
Le tableau vierge au format Word :
Conditions d’utilisation
Les images de ce logiciel ne sont pas libres de droits. Elles sont la propriété exclusive de l’INRA (Jouy-en-Josas).

Données pédagogiques
– Liaison avec le programme : Le niveau concerné est le lycée, en Terminale S, dans la partie Procréation - Du sexe génotypique au sexe phénotypique
– Objectifs notionnels ( Extrait du programme officiel de TS )
Chez les mammifères les structures et la fonctionnalité des appareils sexuels mâle et femelle sont acquises en quatre étapes au cours du développement :
-
- 1ère étape : stade phénotypique indifférencié.
Mise en place d’un appareil génital indifférencié dont le structure est commune aux deux sexes (génétiquement XX et XY).
- 1ère étape : stade phénotypique indifférencié.
-
- 2ème étape : du sexe génétique au sexe gonadique.
- sur le chromosome Y, au cours du développement précoce, le gène Sry est activé et donne naissance à la protéine TDF, signal de développement des gonades en testicules : acquisition du sexe gonadique mâle
- sans la protéine TDF les glandes deviennent des ovaires : acquisition du sexe gonadique femelle.
- 2ème étape : du sexe génétique au sexe gonadique.
– Place dans la démarche
L’existence de différences phénotypiques entre sexe mâle et femelle ont été mises en évidence : la dissection de la souris a permis de dégager les différences phénotypique au niveau des conduits génitaux, l’observation de coupe microscopique de gonade a permis de dégager les différences au niveau de l’organisation de la gonade.
Cette activité permet d’introduire le rôle des hormones dans la mise en place des phénotypes sexuels.
– Objectifs méthodologiques
- Rechercher et trier des données pour répondre à un problème.
- Description, comparaison, classement.
- Utiliser l’outil informatique.
– Principe de l’activité
On cherche à déterminer à partir de quel moment au cours du développement embryonnaire les phénotypes sexuels concernant la gonade et les conduits génitaux se mettent en place.
Pour cela l’élève va rechercher au sein de la base de données des informations sur des photographies d’observations microscopiques réalisées chez des embryons et fœtus de veaux à des âges différents afin de déterminer :
-
- A partir de quel moment on observe une gonade différenciée chez le mâle.
-
- A partir de quel moment on observe une gonade différenciée chez la femelle.
-
- Comment évoluent les canaux de Müller et de Wolf chez le mâle.
-
- Comment évoluent les canaux de Müller et de Wolf chez la femelle.
La saisie d’information permettra d’établir une chronologie de ces événements et de comparer les évolutions dans le cas des deux sexes.
– Évaluations possibles
-
- Saisie pertinente des informations.
- Construire un tableau de synthèse.
- Traduire des informations par une chronologie
- Réaliser une synthèse
Des exemples d’utilisations pédagogiques possibles
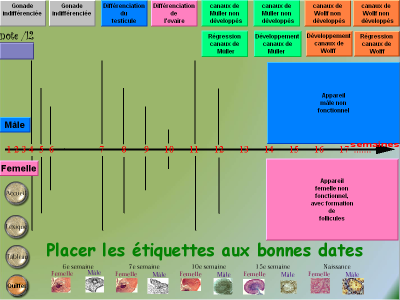
– Construction d’une frise, incluse dans le logiciel : il s’agit de placer des étiquettes correspondant aux principales étapes identifiées dans les documents. Il faut mettre chaque étiquette avec son bord gauche près du trait indiquant la date trouvée dans l’exploration documentaire : par exemple "Gonade indifférenciée" pour le mâle comme pour la femelle le long du trait 6 semaines.
Les étiquettes "canaux... non développés" correspondent à l’état initial.
Pour les grandes étiquettes, le logiciel n’exige pas qu’elles soient
déplacées. Les documents ne permettent d’ailleurs pas de préciser à quelle date elles doivent prendre place.
De la même façon, les documents ne permettent pas de dire quand les voies génitales se mettent en place chez la femelle. Une plus grande
marge de positions est acceptée pour la régression des canaux de Wolff et le développement des canaux de Müller.
Quand les 12 étiquettes sont placées, le score s’affiche. On peut alors l’améliorer en plaçant mieux les étiquettes. On accède à une proposition de corrigé (imprimable) quand on a atteint le score maximal de 12.
– Construction d’un tableau comparatif, qui se lance dans le traitement de texte (permettant ainsi ensuite une impression) en cliquant sur le bouton tableau.
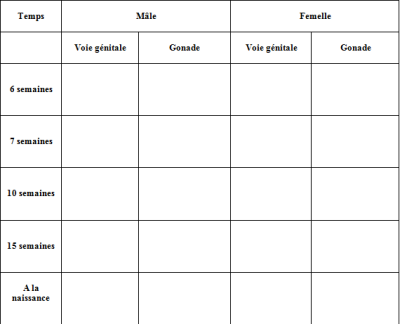
- Le tableau vierge au format Word :
- Un exemple de production élève complétée :
Une mise au point sur les mécanismes à l’origine de la différenciation sexuelle
Pour concevoir ce logiciel, nous avons contacté Mme Cotinot de l’Unité Biologie du développement et Reproduction de l’INRA. Cette rencontre a été l’occasion d’une mise au point scientifique sur ces premières étapes.
– Les mécanismes de différenciation de la gonade chez la femelle
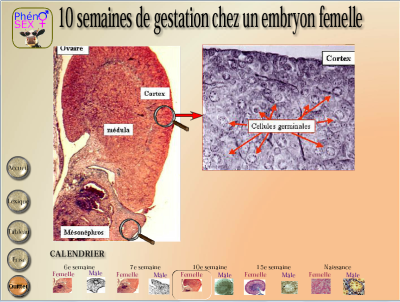
L’observation de l’organisation cytologique de la gonade femelle laisse à penser que rien ne se passe dans les premiers moments de la vie embryonnaire. En effet chez le Veau on ne reconnait un état différencié qu’à six semaines.
Cette indifférenciation n’est que morphologique car si l’on s’intéresse à l’activité moléculaire des cellules gonadiques femelles, il en est tout autrement. Les scientifiques ont ainsi constaté que la folliculogenèse, qui initie la différenciation morphologique de la gonade, ne pouvait pas démarrer tant que les cellules germinales n’étaient pas bloquées en prophase 1. Les scientifiques supposent que les cellules germinales sont programmées pour entrer en méiose au bout d’un nombre de mitose déterminé. Premières à entrer en activité, les cellules germinales vont entamer leur prophase de première division de méiose. Rapidement cette phase se bloque et ce sont sans doute des contrôles moléculaires très fins, déclenchés par l’arrêt de la prophase 1, qui vont permettre à la folliculogenèse de démarrer.
Les cellules germinales bloquées en prophase 1 se distinguent alors des cellules somatiques par leur taille importante.
On pourrait ainsi distinguer une différenciation moléculaire qui précède une différenciation morphologique. Les cellules germinales s’organisent alors en périphérie pour constituer le cortex.
L’entrée en méiose des cellules germinales a lieu pour toutes les espèces de Mammifères pendant la vie embryonnaire. Par contre on constate des différences de chronologie pour l’entrée en folliculogenèse. Chez les souris, elle a lieu après la naissance, chez les ruminants, comme chez l’Homme, elle débutera pendant la vie fœtale.
Pour la plupart des follicules, l’évolution va rapidement s’arrêter au stade follicule primordial. Mais certains prendront ce que l’on peut considérer comme de l’avance puisque leur entrée en latence pourra commencer un peu plus tard au stade follicule primaire, voir secondaire. Quel que soit le moment où ils auront arrêté leur évolution, tous les follicules seront bloqués à la naissance et le resteront au minimum jusqu’à la puberté.
– Les mécanismes de différenciation de la gonade chez le mâle
Si l’hypothèse d’une programmation des cellules germinales pour entrer rapidement en méiose est recevable, il faut envisager l’existence d’un mécanisme qui bloque rapidement l’évolution des cellules germinales chez le mâle. En effet à la naissance, les cellules germinales du mâle sont bloquées en phase G0G1 de mitose et le resteront au minimum jusqu’à la puberté. On constate effectivement une organisation très précoce de la gonade mâle au cours du développement embryonnaire
C’est l’expression du gène SRY chez les cellules du stade indifférencié qui va entrainer chez les cellules somatiques une cascade de réactions moléculaires à l’origine de leur différenciation en cellule de Sertoli.
Une fois différenciée les cellules de Sertoli vont s’organiser pour constituer un cordon autour des cellules germinales sur lesquelles elles exerceront une inhibition qui bloquera leur entrée en méiose. Le(s) facteur(s) à l’origine de cette inhibition n’a pas encore été isolé.
Les cellules de Sertoli vont également attirer des cellules du mésonéphros qui vont migrer vers la gonade. Ces cellules très plates deviendront les cellules péritubulaires myoïdes. Les tubes séminifères sont alors constitués. Les cellules germinales s’organiseront de la périphérie vers le centre du tube séminifère.
– Deux évolutions qui se ressemblent mais différent dans leur chronologie
La mise en place des tubes séminifères et des follicules se fait donc selon les mêmes concepts mais les évolutions ne se font pas au même moment. Dans les deux types de gonades on retrouve les mêmes types de cellules en miroir :
| Origine | Femelle | Mâle | Rôle |
|---|---|---|---|
| Gonade | Cellules folliculaire | Cellules de Sertoli | Cellules de soutien |
| Gonade | Cellules germinales | Cellules germinales | Production des gamètes |
| Gonade | Cellule de la thèque | Cellule de Leydig | Stéroïdogenèse |
| Mésonéphros | / | Cellules péritubulaire | / |
Dans les deux cas la différenciation ne reprendra qu’à la puberté.
Auteurs : Le logiciel a été réalisé par le groupe de travail « PRODSVT Lycée » de l’académie de Versailles : Muriel BLOT, Bruno BOUCHER, Christian BREBAN, Stéphan CAMILLO, Laurent GUERRE, Sébastien HECKMANN, Jean-Claude LYONNET et Arnaud SALOME.
Remerciements : Mme Cotinot de l’Unité Biologie du développement et Reproduction de l’INRA.
