propriétés physiques et chimiques
Documents " Lambert industries 1972 "
Sources : cours de minéralogie de R.Fischesser(1950)
Propriétés physiques
clivage : parmi les 4 Possibilités, g 1 est très facile
et très parfait. Les lamelles
obtenues sont flexibles et élastiques.
densité: 2,32g/cml (2,30 calculée par les rayons X).
dureté dans l'échelle de Mohs :1,5 à 2 suivant
l'orientation de la fac
Propriétés chimiques
solubilité : le gypse est peu soluble dans
l'eau, sa solubilité exprimée en grammes de Ca S04 dans 1
000 grammes de solution est de 1,75 g par litre à 0 °C. Elle
passe par un maximum de 2,1 g par litre aux environs de 38 °C pour retomber
à 1,69 g par litre à 1 00 °C.
la solubilité du gypse est sensiblement plus forte dans l'eau salée.
L'eau contenant du gypse dissout est appelée : eau séléniteuse . Le savon ne mousse pas dans l'eau séléniteuse
déshydratation : sous l'action plus ou
moins prolongée de la chaleur on obtient (en laboratoire)
entre 1 1 0 °C et 1 30 °C (correspondant au départ des 3/4
de l'eau du gypse) le demi-hydrate Ca SO4, 1/2 H2 0 (élément
essentiel du plâtre) capable de reprendre son eau
à froid en faisant prise.
Vers 143 °C (correspondant au départ de la totalité de
l'eau du gypse) L'anhydrite ne s'hydrate plus que très lentement
et sans faire prise. Vers 1 100 °C un anhydrite recouvre son aptitude
à faire une prise très lente pour donner une masse dure et
tenace.Vers 1 350 °C fusion et dissociation de l'anhydrite (1).
la pierre à plâtre se rencontre dans la nature-sous deux formes :
- le sulfate de calcium à deux molécules d'eau Ca S04, 2H2 0 ou gypse, très abondant.
- le sulfate anhydre CaSO4 ou anhydrite, plus rare.
GYPSE
CaSO4, 2H2 0 cristallisé dans le système monoclinique.
Variétés : voir des échantillonscristallisé (sélénite) en cristaux distincts ou lamelleux et transparents.
fibreux, agrégats cohérents avec une structure fibreuse.
massive ou saccharoïde (albâtre).
grains fins, blancs ou délicatement ombrés, souvent colorés et pouvant contenir des traces d'argile, d'oxyde de fer, de calcite (Ca CO2) ou d'anhydrite (Ca SO4).
Formes :
cristaux souvent gros, généralement aplatis selon g 1) ou prismatiques et allongés parallèlement à d.macles, parmi celles possibles : la macle en fer de lance
structure :
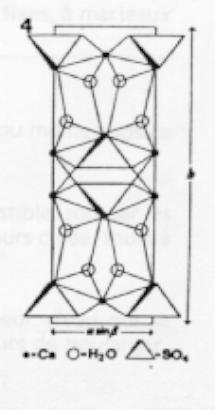
Elle est constituée de feuillets comme le montre la fig.4. Chaque molécule d'eau est liée non seulement à un atome de calcium et à un atome d'oxygène de son feuillet, mais encore, à un atome du feuillet adjacent. Ces dernières liaisons qui unissent les feuillets les uns aux autres sont très faibles. Ainsi, s'expliquent le clivage facile (g 1) et la forte anisotropie de dilatation. (1).(1) Wooster Zs. Kr 94 37
5 (1936)