Vocabulaire commun
- A -
Albédo : Rapport entre l'énergie réfléchie et l'énergie incidente pour
le spectre solaire de 0,3 à 1 µm, en % de 0 à 100, ou de 0 à 1.
La valeur est égale à 0 pour un milieu totalement absorbant.
La valeur est égale à 1 pour un milieu totalement réfléchissant.
La valeur est entre 0,3 et 0,7 pour le milieu naturel.
Atome : unité de constitution de la matière.
- D -
Dégazage : action d'éliminer les gaz dissous d'un liquide, d'un solide.
Densité : la densité d d'un corps liquide ou solide, par rapport à l'eau, est égale au quotient de la masse d'un volume V de ce corps par la masse mo d'un même volume d'eau. Ces deux volumes étant mesurés dans les conditions de température et de pression.
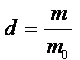 |
ou
|
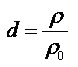 |
![]() : masse volumique du corps
(g.cm-3)
: masse volumique du corps
(g.cm-3)
![]() 0: masse volumique
de l'eau (g.cm-3)
0: masse volumique
de l'eau (g.cm-3)
La densité s'exprime par un nombre sans unité.
D'après la définition de la densité, la densité de l'eau est égale à 1. Par
conséquent, si un solvant a une densité inférieure (phase supérieure)
à 1, il sera dans la phase supérieure (phase inférieure).
La densité est une grandeur physique permettant l'identification d'une espèce
chimique. Celles-ci se trouvent dans des tables qui sont universelles.
Dilution : action d'ajouter de l'eau à une solution aqueuse pour obtenir une solution moins concentrée.
Dissolution : action de dissoudre une espèce chimique (solide, liquide
ou gaz) dans un solvant. À toute dissolution est associée une équation chimique
prenant en considération les états physiques des espèces.
Exemples :
- dissolution du dioxyde de carbone dans l'eau :
CO2 (g) + H2O (l) ---------------> HCO3-(aq) + OH-(aq)
- dissolution du chlorure de sodium dans l'eau :
NaCl (s) ---------------> Na+(aq) + Cl-(aq)
- E -
Eclairement : flux énergétique reçu par unité de surface et par unité de temps en J.s-1.m-2 ou en W.m-2.
Elément chimique : ensemble des entités chimiques (atomes ou ions, isolés
ou engagés dans un édifice chimique) ayant le même numéro atomique Z (même nombre
de protons).
exemple : le métal cuivre, l' ion Cu2+, l'oxyde CuO, contiennent
l'élément Cu.
Équation de réaction : à toute réaction chimique, on associe une équation de réaction qui en constitue l'écriture symbolique :
Réactifs ---------------> Produits
Espèce chimique : ensemble d'entités moléculaires, atomiques ou ioniques identiques (à utiliser dans le cas d'une description macroscopique).
Espèce organique : espèce chimique qui, par combustion complète avec le dioxygène produit de l'eau et du dioxyde de carbone.
- F -
Flux énergétique : puissance rayonnée / reçue par unité de temps en W (1 Watt = 1 J.s-1)
Force d'attraction gravitationnelle :
Dans la loi de la gravitation, Newton stipule : « Tout corps matériel dans
l’univers attire tout autre corps avec une force directement proportionnelle
au produit de leurs masses et inversement proportionnelle au carré de leur distance
».
Fossilisation : transformation de matières issues du monde vivant en roches sédimentaires.
- I -
Infrarouge (IR) : domaine du spectre électromagnétique correspondant à des rayonnements de longueur d'onde (dans le vide) supérieures à celles de la lumière " visible ".
Intensité de la pesanteur terrestre :
En première approximation, et sans tenir compte des effets de la rotation
de la terre sur elle-même, on peut écrire que le poids est égal à la force d’attraction
gravitationnelle soit P = F
Or P = m.g d’où l’intensité de la pesanteur : g = (on remarquera que g indépendant
de la masse m de l’objet, mais lié à la masse de la terre).
Ions : en perdant un ou plusieurs électrons, un atome ou groupement d'atomes devient ion positif ou cation et en gagnant un ou plusieurs électrons, un atome ou groupement d'atomes devient ion négatif ou anion.
Isotopes : ensemble d'atomes ayant même numéro atomique Z (donc même nombre de protons) mais un nombre de nucléons A différent (donc un nombre de neutrons différent).
- L -
Liaison covalente : mise en commun d'une paire d'électrons entre deux atomes.
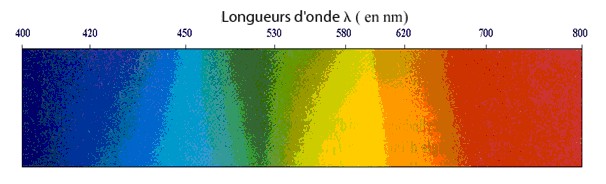
Longueur d'onde (lambda) : grandeur caractéristique d'une radiation monochromatique. Unité de longueur d'onde utilisée en SPC : le nanomètres, en SVT : le micromètre (conserver plutôt les nm). Elle dépend du milieu transparent étudié, on donne souvent sa valeur dans le vide.
Lumière : transport d'énergie sans transport de matière.
Lumière blanche : ensembles, les radiations du visible forment la lumière blanche.
Lumière monochromatique : rayonnement caractérisé par une fréquence précise.
Lumière polychromatique : rayonnement dont le spectre est caractérisé par la contribution de plusieurs longueurs d'onde.
Lumière " visible " : domaine du spectre électromagnétique auquel est
sensible l'œil humain. Il s'étend du rouge (longueur d'onde dans le vide d'environ
800 nm) au violet (longueur d'onde dans le vide d'environ 400 nm).
NB : Les objets éclairés sont visibles et non la lumière elle-même.
Luminance : flux énergétique des radiations émises et/ou réfléchies par un objet pour une longueur d'onde et suivant un angle et une surface donnée en W/m2/stéradian (stéradian= angle de visée)
- M -
Masse volumique : la masse volumique est le rapport de la masse d'un corps sur le volume de solvant.
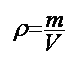 |
|
La masse volumique peut s'exprimer en kg.m-3 ou en g.cm-3.
La densité est une grandeur physique permettant l'identification d'une espèce
chimique. Celles-ci se trouvent dans des tables qui sont universelles.
Exemple :
La masse volumique de l'eau est de, à 4°C :
1 g.cm-3
1 kg.L-1
1000 kg.m-3
Matière organique : substance constituée d'espèces organiques.
Molécules : assemblage d'atomes.
- N -
Nombres stœchiométriques : nombres placés devant la formule de chaque espèce chimique intervenant dans l'équation de réaction. Ils sont " ajustés " pour respecter la conservation des éléments chimiques et des charges électriques au cours d'une transformation chimique.
- P -
Photosynthèse : synthèse de matières organiques à partir de molécules minérales, utilisant la lumière comme source d'énergie.
Précipitation : transformation chimique au cours de laquelle il se forme
un solide ionique peu soluble dans l'eau.
Exemple : précipitation du carbonate de calcium :
Ca2+(aq) + CO32-(aq) ---------------> CaCO3 (s)
Pression : la pression correspond au rapport entre la force pressante F exercée par les molécules d'un gaz sur les parois d'un récipient et la surface S de cette paroi.
|
P =
|
|
avec
F: force en N,
S: surface en m2,
P: pression en Pa.
Par extension, cette notion s'applique aux autres fluides.
Produits : espèces chimiques apparues lors de la transformation.
- R -
Radiation : rayonnement monochromatique auquel est associé une longueur d'onde (dans le domaine de la lumière visible, une couleur est associée à chaque radiation).
Réactifs : espèces chimiques disparaissant lors de la transformation.
Réaction chimique : modèle de la transformation chimique au niveau macroscopique.
Réflectance : Rapport entre l'énergie émise et/ou réfléchie par un objet et l'énergie des radiations incidentes reçues, pour une longueur d'onde, un angle, une surface, donnés en %. Les satellites mesurent des réflectances qui sont évaluées en % et codés sur 8bits, soit 256 valeurs. A la valeur 100% de réflectance est attribuée la valeur 255.
Résolution spatiale de l'image satellitale :
- Elle mesure le côté d'un pixel Exemple : 20 mètres de résolution signifie
que chaque pixel représente un carré de surface 400m2.
- Les surfaces des pixels vont de quelques dm2 à des centaines de
m2.
- L'augmentation de la résolution va de pair avec la diminution de la taille
de la scène.
Résolution spectrale : c'est la capacité d'un capteur à utiliser de
petites bandes de longueur d'onde. Elle permet de différencier les matériaux.
En mode panchromatique = une seule bande.
En mode multi spectral = 3 bandes (SPOT) ou un peu plus.
En mode hyper spectral = plusieurs bandes jusqu'à des centaines.
Résolution radiométrique : c'est la capacité à reconnaître de petites différences dans le spectre électromagnétique. Si elle est fine, le capteur est sensible à de petites différences dans l'intensité de l'énergie reçue. Elle est liée à la résolution numérique (codage sur 8 bits généralement).
Respiration : réactions d'oxydation de matières organiques permettant de produire l'énergie nécessaire aux cellules vivantes.
- S -
Spectre : figure obtenue par la décomposition d'une lumière en radiations monochromatiques. Il peut être d'émission ou d'absorption, continu ou de raies.
Substance chimique : désigne un matériau, constituée d'une ou plusieurs
espèces chimiques.
exemple : sucre , café …
Synthèse : opération qui consiste à fabriquer, par une transformation chimique, une espèce à partir d'autres espèces chimiques.
Systèmes chimiques : mélange d'espèces chimiques dont on étudie l'évolution.
- T -
Transformations chimiques : passage de l'état initial à l'état final d'un système chimique lorsque l'évolution du système s'accompagne de l'apparition de nouvelles espèces chimiques.
|
État initial
Température Ti, pression pi Espèces chimiques introduites |
Transformation ----------------------> chimique |
État final
Température Tf, pression pf Espèces chimiques : - nouvelles - restantes |
- U -
Ultraviolet (UV) : domaine du spectre électromagnétique correspondant à des rayonnements de longueur d'onde (dans le vide) inférieures à celles de la lumière " visible ".
Exemple du spectre de la lumière blanche :
Unité de g : d’après la relation P = m.g ; l’intensité de la pesanteur
s’exprime en N.kg-1.
Mais à partir du principe fondamental de la dynamique dans le cas d’une
chute libre (l’objet est soumis seulement à son poids) : P = m.a d’où a = g
(avec a l’accélération du centre d’inertie de l’objet), g s’exprime en m.s-2.
Unité de pression : l'unité dans le système international est le Pascal
(Pa).
D'autres unités peuvent être utilisées :
- le bar : 1 bar = 105 Pa ;
- le millimètre de mercure (mm Hg) :
la pression atmosphérique moyenne est de 760 mm Hg = 1,013.105 Pa.
© 2005-2006 | Imprimer | Télécharger | Haut de page | Quitter
